Versie: maart 2024
10.7.1 Rhizomanie
10.7.1.1 Bietenrhizomanievirus
Rhizomanie is de aanduiding voor de symptomen van het bietenrhizomanievirus (Beet Necrotic Yellow Vein Virus (BNYVV)). De symptomen zijn: geelverkleurd blad met een steile verlengde bladsteel, de zogenoemde ˈblinkerˈ, en insnoering van de wortel met de vorming van een wortelbaard. Het virus wordt overgebracht door de bodemschimmel Polymyxa betae. De schimmel P. betae komt op alle grondsoorten voor. Zonder aanwezigheid van het virus veroorzaakt deze bodemschimmel weinig aantoonbare schade in de bieten. Bij hoge dichtheden van deze schimmel is wel een vertraging in de ontwikkeling van jonge planten, wortelverbruining en wortelbaardvorming waargenomen.
Binnen het rhizomanievirus zijn meerdere typen bekend. De bekendste zijn: A, B en P. De typen A en B hebben vier strengen RNA (erfelijk materiaal van virussen) en virustype P vijf strengen RNA. Soms wordt de vijfde RNA streng ook bij het A of B type gevonden. Het P-type is genoemd naar het gebied Pithiviers in Frankrijk, waar het voor het eerst is waargenomen. In Nederland komen het A- en B-type voor (figuur 10.7.1). Het P-type is tot nu toe niet in Nederland aangetroffen.
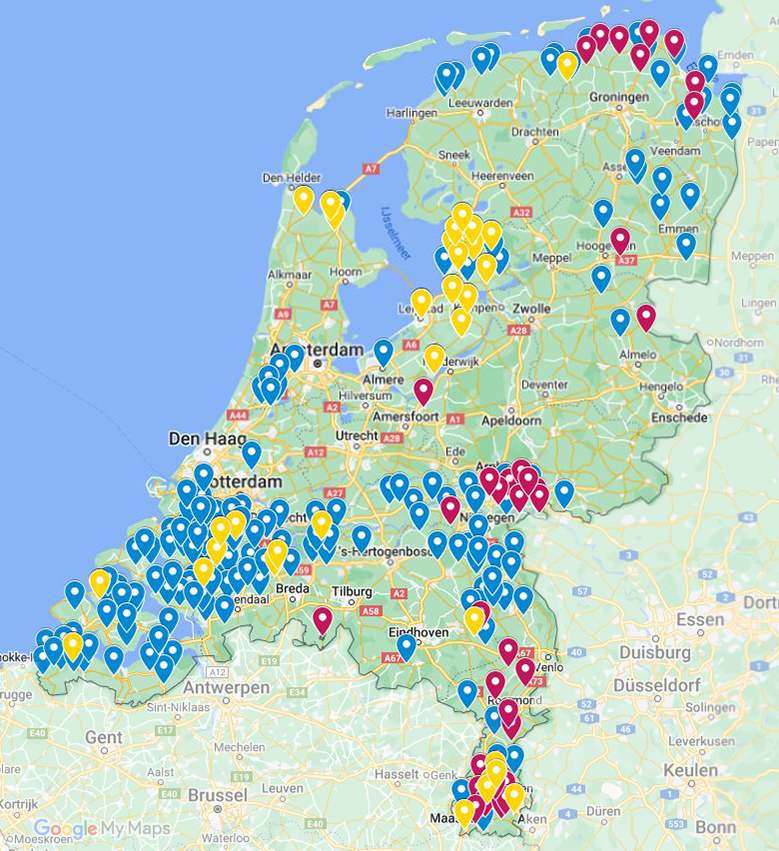
Figuur 10.7.1 De verspreiding van het rhizomanievirus in Nederland. De blauwe punten geven het A-type en de rode punten het B-type weer. Locaties waar zowel het A-type als B-type aangetroffen is worden weergegeven met de gele punten. De gegevens zijn afkomstig uit grond- en bietenmonsters van proefvelden en praktijkpercelen in de periode 2002-2021.
10.7.1.2 Levenscyclus rhizomanie
Het rhizomanievirus is afhankelijk van zijn vector, de bodemschimmel Polymyxa betae. Zonder aanwezigheid hiervan kan het virus de plant niet infecteren. De zwemsporen (zoösporen) van de schimmel dringen de haarwortels binnen en brengen het rhizomanievirus over (figuur 10.7.2). Het virus vermeerdert zich daar en verspreidt zich naar andere wortels die daardoor afsterven. Dit gebeurt voornamelijk in bieten en spinazie. Het vermoeden bestaat dat het virus zich ook in een aantal onkruidsoorten kan vermeerderen.
Eenmaal binnengedrongen in de haarwortels vormt P. betae daar schimmelbolletjes, die samenvloeien tot een plasmodium. Na enkele keren deze cyclus te hebben volbracht, worden de rustsporen gevormd. Deze kunnen meer dan vijftien jaar vitaal in de grond aanwezig blijven. P. betae kon worden aangetoond in wortels van planten uit de ganzenvoetachtigen en posteleinachtigen. Alleen binnen de ganzenvoetachtigen (waaronder biet en spinazie) komen goede waardgewassen voor. Binnen de andere plantengeslachten die als akkeronkruiden kunnen voorkomen, vermeerdert de schimmel zich in geringe mate. Virusvrije isolaten van P. betae nemen het virus op als zij zich vermeerderen in planten die met het virus geïnfecteerd zijn.
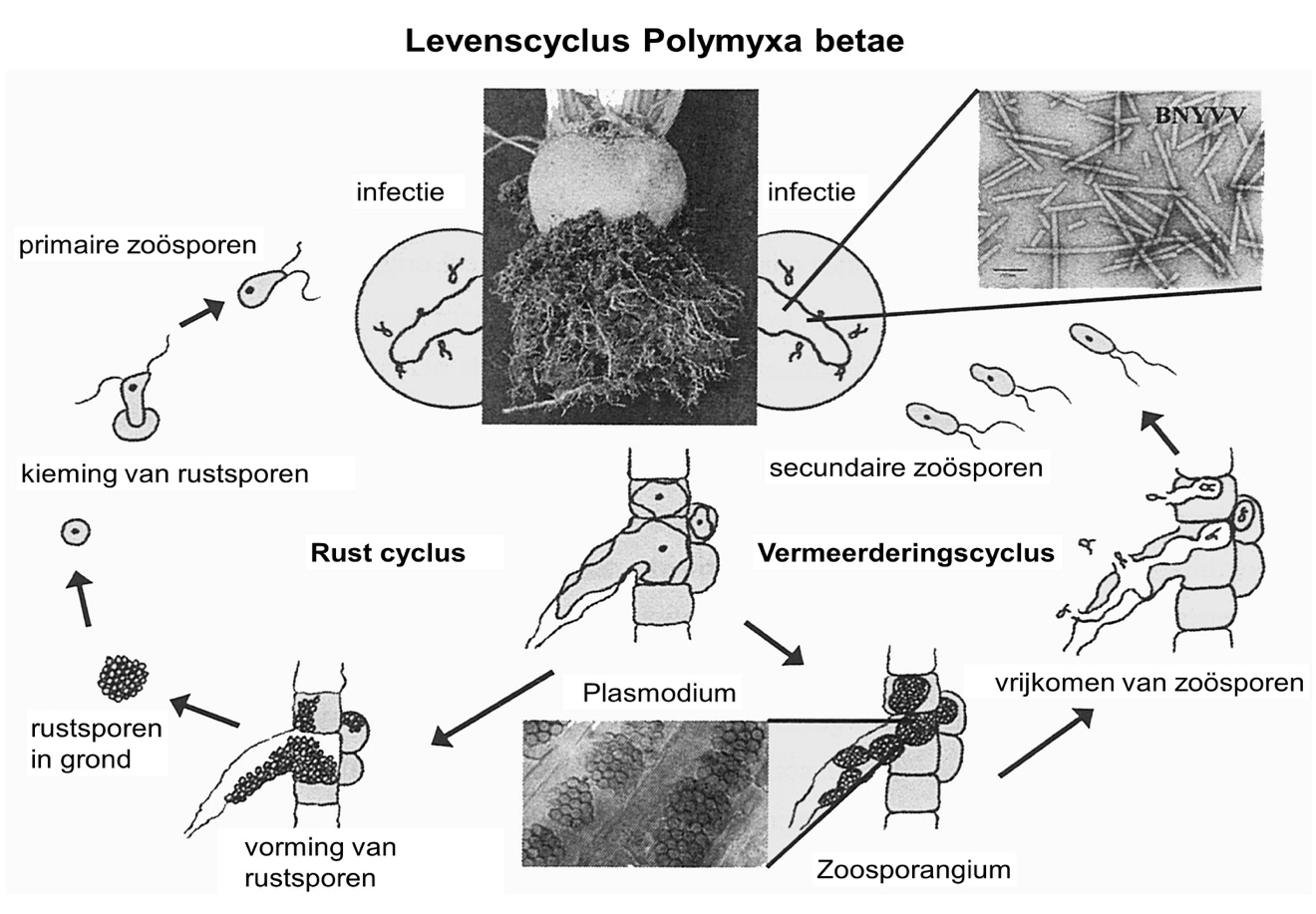
Figuur 10.7.2 Levenscyclus van het rhizomanievirus. Het virus is voor de verspreiding en vermeerdering afhankelijk van zijn vector, de bodemschimmel Polymyxa betae (naar Pferdmenges, 2007).
10.7.1.3 Symptomen rhizomanie
Door het rhizomanievirus blijven de bieten achter in groei. Als een biet voorzichtig uit de grond wordt gehaald, vertoont de wortel insnoeringen en soms vertakkingen. Doordat de vermeerdering en verspreiding van het virus plaatsvindt in de haarwortels, sterven deze af (figuur 10.7.3). Hierdoor vormen zich steeds weer nieuwe wortels en uiteindelijk ontstaat de kenmerkende baardvorming aan de biet (rhizo = wortel, manie = dolheid). Het virus verplaatst zich ook naar het onderste gedeelte van de penwortel. Hierdoor raken de vaatbundels verstopt. Dit is soms duidelijk te zien aan de bruinverkleuring van de vaatbundels bij het doorsnijden (figuur 10.7.4). De aantasting door het rhizomanievirus kan ook bovengrondse symptomen veroorzaken. Hierbij verkleurt het blad geel en staat steil rechtop, de zogenoemde ˈblinkerˈ (figuur 10.7.5). Er kunnen ook allerlei gebreksverschijnselen ontstaan, omdat voedingselementen onvoldoende kunnen worden getransporteerd door de verstopte vaten. Meer fotoˈs en informatie zijn te vinden in de applicatie ˈZiekten en Plagenˈ.

Figuur 10.7.3 Zware baardvorming met veel afgestorven haarwortels.

Figuur 10.7.4 Vanuit de wortelpunt kan bruinverkleuring van de vaatbundels ontstaan.

Figuur 10.7.5 Een blinker in een bietenperceel. Kenmerkend is het egaal licht gekleurde blad dat steil rechtop staat. De wortel vertoont meestal insnoeringen en baardvorming.
Alle in Nederland verkochte suikerbietenrassen zijn sinds 2007 partieel resistent tegen rhizomanie. Deze resistentie berust op het gebruik van één resistentiegen (Rz1). Ook bij toepassing van deze rassen kunnen later in het seizoen een beperkt aantal planten met een bleek geel verkleurd loof voorkomen. Dit zijn de zogenaamde ˈblinkersˈ, waarvan er niet meer dan circa 2-5% in een perceel aanwezig mogen zijn. Echter, wanneer grote aantallen blinkers in plekken bij elkaar staan, kan dit duiden op problemen met rhizomanie (figuur 10.7.6). Dit kan voorkomen bij een hoge virusdruk of een agressieve variant van het rhizomanievirus.
Sinds 2004 worden percelen gemeld bij de afdeling diagnostiek waar extreem veel blinkers of plekken of stroken met blinkers voorkomen. In 2010 is vastgesteld dat op deze percelen een resistentiedoorbrekende variant (bijvoorbeeld AYPR of TYPR) van het A-type voorkomt. Deze varianten doorbreken de resistentie van het resistentiegen (Rz1-gen). Om dergelijke varianten te beheersen is aanvullende resistentie nodig. Een ras met aanvullende resistentie tegen rhizomanie bevat twee resistentiegenen (Rz1 en Rz2 of RzX). Dit wordt bij de zaadbestelling expliciet bij deze rassen vermeld. In figuur 10.7.7 staan de kerngebieden weergegeven waarin op alle percelen het beste voor een ras met aanvullende resistentie tegen rhizomanie kan worden gekozen, vanwege het vele voorkomen van de resistentiedoorbrekende varianten.

Figuur 10.7.6 Bleekgele verkleuring van het blad in plekken op het perceel, de eerste aanwijzing van een mogelijke aantasting door rhizomanie. De wortels van deze bieten vertonen vaak insnoeringen en wortelbaarden.
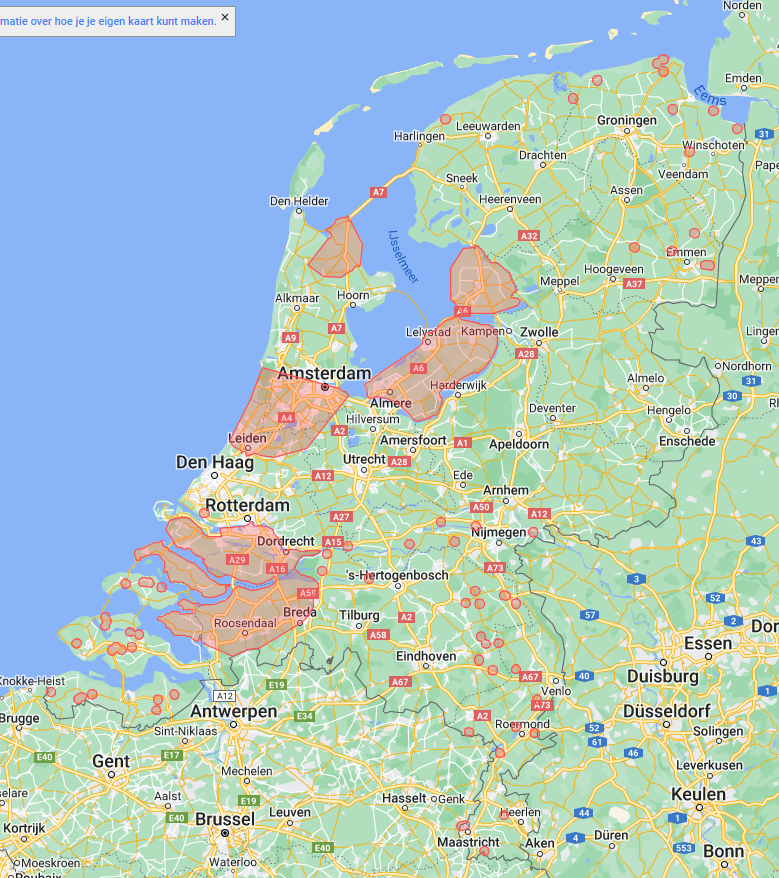
Figuur 10.7.7 Gebieden waar resistentiedoorbrekende varianten van het rhizomanievirus (A-type; AYPR, TYPR en VYPR) in suikerbiet- of bodemmonsters zijn aangetroffen. De rassenkeuze module van Cosun Beet Company houdt hier rekening met aanvullende resistentie tegen rhizomanie op alle percelen (Kaart: Cosun Beet Company).
10.7.1.4 Schade
De directe schade door rhizomanie kan bestaan uit:
- een laag suikergehalte. Bij zware aantasting kan het suikergehalte zakken tot 10%;
- een gewichtsverlies van de wortel dat kan oplopen tot 70% van de normaal haalbare opbrengst;
- een afname van de winbaarheid door een toename van het natriumgehalte en een daling van het suikergehalte bij een gelijk of lager gehalte aan aminoN;
- een stijging van het tarrapercentage door de onregelmatige vorm van de wortel en de zware wortelbaarden;
- problemen bij verwerking in de fabriek, omdat bij zeer zware aantasting wortelrot kan optreden.
Leveringsgegevens
Uit de analysegegevens van de individuele vrachten geleverde bieten kan men afleiden of er sprake is van rhizomanie. Dit geldt alleen als er sprake is geweest van grote plekken in het perceel. Kleine haardjes zullen op deze manier niet worden opgemerkt. Als het natriumgehalte hoger is dan normaal en het suikergehalte lager, bij een gelijk of laag aminoN, kan dit duiden op rhizomanie. Wanneer dit op de fabriek in het tarreerlokaal wordt geconstateerd, is er echter al een flink opbrengstverlies geleden.
10.7.1.5 Verspreiding
Het rhizomanievirus kan via vocht en grond worden verspreid, waarbij vocht voor het infectieproces van de bodemschimmel P. betae een vereiste is. Rhizomanie verspreidt zich meestal op verschillende manieren, deze worden hieronder verder toegelicht.
De kans op verspreiding van rhizomanie via het bietenzaad is klein door de diverse (schonings)behandelingen die het zaad ondergaat. Plantmateriaal, zoals pootaardappelen, plantuien en bollen, kunnen echter wel gemakkelijk besmettingen verslepen. Daarbij is het risico van verspreiding afhankelijk van de hoeveelheid aanhangende grond die wordt verplaatst en de verdeling in het veld. Onderzoek heeft aangetoond dat de gemiddelde hoeveelheid aanhangende grond bij pootaardappelen voldoende rhizomanievirus bevat om na twee bietenteelten virusvermeerdering het virus terug te vinden in de grond van het perceel.
Omdat de ruststructuren van de schimmel P. betae samen met het rhizomanievirus zeer lang in de grond levenskrachtig blijven, is het verplaatsen van grond een zeer belangrijke verspreidingswijze voor deze ziekte. Hierbij moet men denken aan de tarragrond van de verwerkende industrie, zoals frietfabrieken, peen- en witlofwasserijen, die wordt gebruikt om bijvoorbeeld sloten te dempen of laaggelegen perceelgedeelten op te vullen. Ook grond aan machines kan de ziekte van perceel naar perceel verspreiden. Bij het rooien van bieten en aardappelen kan vrij veel grond via de machines worden versleept van het ene bedrijf naar het andere. Dit is ook een potentiële bron voor verspreiding. De kans op het over een geheel perceel aanbrengen van infectieus materiaal, zoals bij besmet plantgoed, is echter veel geringer.
Betacal is geen bron van besmetting, omdat bij het proces in de fabriek zulke hoge temperaturen worden bereikt dat het virus dit niet overleeft.
Water en slootslib
Vooral de rustorganen (cystosoren) van de schimmel kunnen lange tijd samen met het rhizomanievirus onder water levenskrachtig blijven. Vanuit een besmet perceel komen ze via de drainagebuizen in de sloten terecht en zinken naar de bodem. Uit een besmette watergang kan de ziekte zich verspreiden naar een nog onbesmet perceel, door infiltratie, beregening, gewasbespuitingen en uitbaggeren (figuur 10.7.8). In samenwerking met verschillende waterschappen is in het verleden onderzoek verricht, waaruit bleek dat vooral het schonen van watergangen en vervolgens uitspreiden van bagger over het perceel verspreiding van rhizomanie sterk bevordert. Maatregelen om dit te voorkomen, zoals het afvoeren van besmette bagger of het beregenen met uitsluitend grondwater, zijn kostbaar en bieden nog geen garantie op verbetering. Beregening met oppervlaktewater kan de ziekte verspreiden over het volledige perceel wanneer het rhizomanievirus zich in het water bevindt.

Figuur 10.7.8 Verspreiding van rhizomanievirus via water.
Overtollig bietenmateriaal en mest
Blad en plantresten worden na de oogst op het perceel achtergelaten en ingewerkt. Daardoor is de kans op verspreiding naar andere percelen langs deze weg gering geworden. Grond en bietenresten van de bietenbewaarhoop kunnen wel zorgen voor besmetting wanneer ze naar het perceel worden teruggebracht. Breng dit soort resten altijd terug op het perceel waar het vandaan komt. Of blad-, biet- en kopresten die worden vergist, ook een risico van verspreiding vormen via het digestaat is nog onbekend.
Wel is aangetoond dat besmettingen het maag- en darmkanaal van herkauwers kunnen overleven. De kans dat via deze weg de ziekte wordt verspreid, is echter vrij gering vergeleken met de andere mogelijke verspreidingswegen.
10.7.1.6 Beheersing van rhizomanie
Rhizomanie is in de meeste gevallen goed te beheersen door de inzet van (aanvullend) partieel resistente rassen. Daarnaast kan men een vroege aantasting beperken door te streven naar een goede bodemstructuur. Een slechte structuur van de bodem heeft vaak tot gevolg dat er lang water op het land staat. Hierdoor kan een vroege en zware aantasting ontstaan. Een goede grondbewerking en drainage, waardoor water snel wordt afgevoerd, verminderen de kans op een vroege aantasting. Een goede afwatering en een losse structuur maken dat de bodem in het voorjaar snel droogt. Hierdoor komen sporen van de schimmel Polymyxa betae, de overbrenger van het virus, minder gemakkelijk en daardoor later in het seizoen in wortels terecht. Ook bij rhizomanie betekent een late aantasting beperking van de schade. Door zo vroeg mogelijk te zaaien, is er dus een voorsprong te behalen.
Het is niet mogelijk om de vector P. betae te bestrijden met fungiciden of grondontsmetting.
10.7.1.7 IRS-advies rhizomanie
- Alle beschikbare rassen zijn partieel resistent. Maar teel op percelen met een resistentie doorbrekende variant altijd een ras met aanvullende resistentie tegen rhizomanie. In de kernregio’s is een ras met ‘zeer goede’ of ‘goede’ aanvullende resistentie op alle percelen aanbevolen (figuur 10.7.7). Een ras met ‘matige’ aanvullende resistentie tegen rhizomanie wordt alleen aanbevolen als er niet al te veel rhizomanieresistentiedoorbraak verwacht wordt of het ras een specifieke ander belangrijke eigenschap heeft die nodig is op het perceel.
- Zorg voor een goede structuur van de bodem en afwatering van het perceel, om een vroege aantasting zoveel mogelijk te beperken.
- Probeer zo vroeg mogelijk te zaaien. Dit geeft een voorsprong van het bietenplantje op het virus.
10.7.2 Vergelingsziekte
Vergelingsziekte kan voor grote schade zorgen in de opbrengst en de kwaliteit van de suikerbieten. Vergelingsziekte wordt veroorzaakt door virussen die overgedragen worden door besmette bladluizen, voornamelijk de groene perzikluis (Myzus persicae). Meer informatie over bladluizen en het overbrengen van de vergelingsvirussen is te vinden in paragraaf ˈBladluizenˈ (10.3.3.4).
Er zijn meerdere soorten virussen die vergelingsziekte kunnen veroorzaken. De drie meest voorkomende zijn sterk vergelingsvirus (BYV; Beet Yellows Virus), zwak vergelingsvirus (BMYV; Beet Mild Yellowing Virus) en bietenchlorosevirus (BChV; Beet Chlorosis Virus) (figuur 10.7.9 t/m 10.7.11). Het bietenmozaïekvirus (BtMV) en het Turnip Yellows Virus (TuYV) komen slechts sporadisch voor. De eerste infecties van suikerbieten met vergelingsvirussen vinden meestal plaats vanaf eind april/begin mei. De virussen zorgen allen voor geelverkleuring van de bladeren, waarbij de bladeren dik en leerachtig aanvoelen. Later kan verbruining optreden, omdat secundaire schimmels (Alternaria) deze aangetaste bladeren binnendringen. De symptomen van vergeling verschijnen in kenmerkende ronde haardjes (figuur 10.7.12). In de figuren 10.7.13 tot en met 10.7.15 is een kaart van Nederland te zien waar de verschillende virussen zijn aangetroffen. Zowel BYV, BMYV als BChV komen in heel Nederland voor. Vaak komen op één perceel meerdere vergelingsvirussen tegelijkertijd voor.

Figuur 10.7.9 Vergelingsziekte veroorzaakt door BYV.

Figuur 10.7.10 Vergelingsziekte veroorzaakt door BMYV.

Figuur 10.7.11 Vergelingsziekte veroorzaakt door BChV.

Figuur 10.7.12 Kleine, typisch ronde plekken vergelingsziekte.
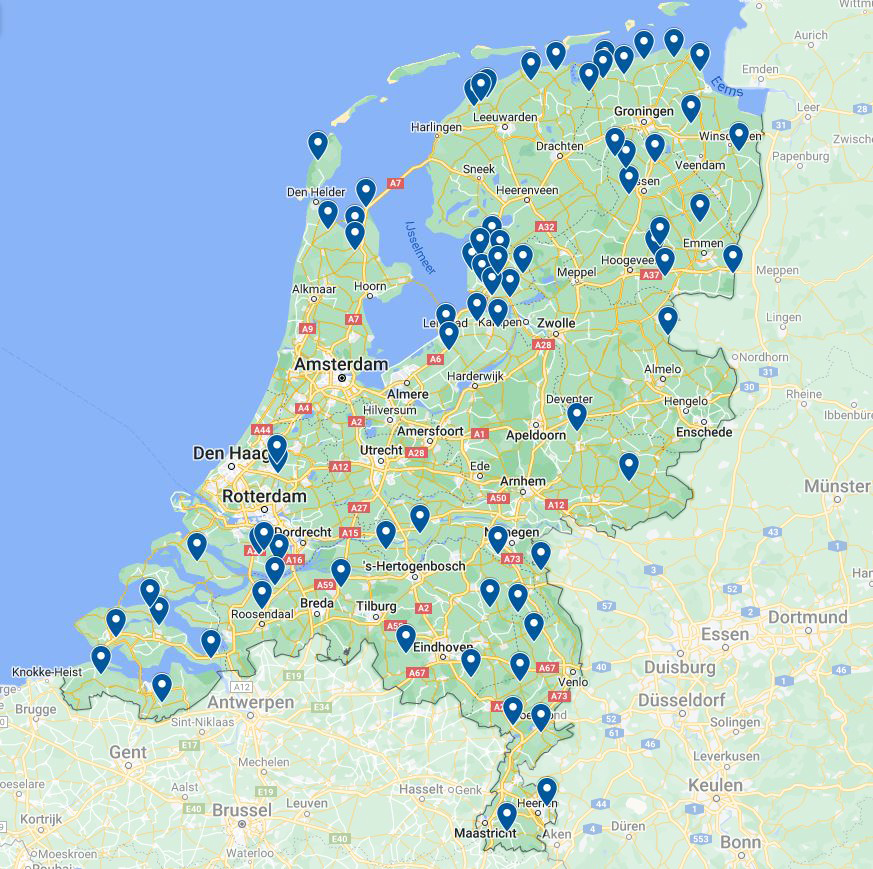
Figuur 10.7.13 Percelen besmet met BYV (blauw) op basis van de ingezonden diagnostiekmonsters in 2020 tot en met 2022.
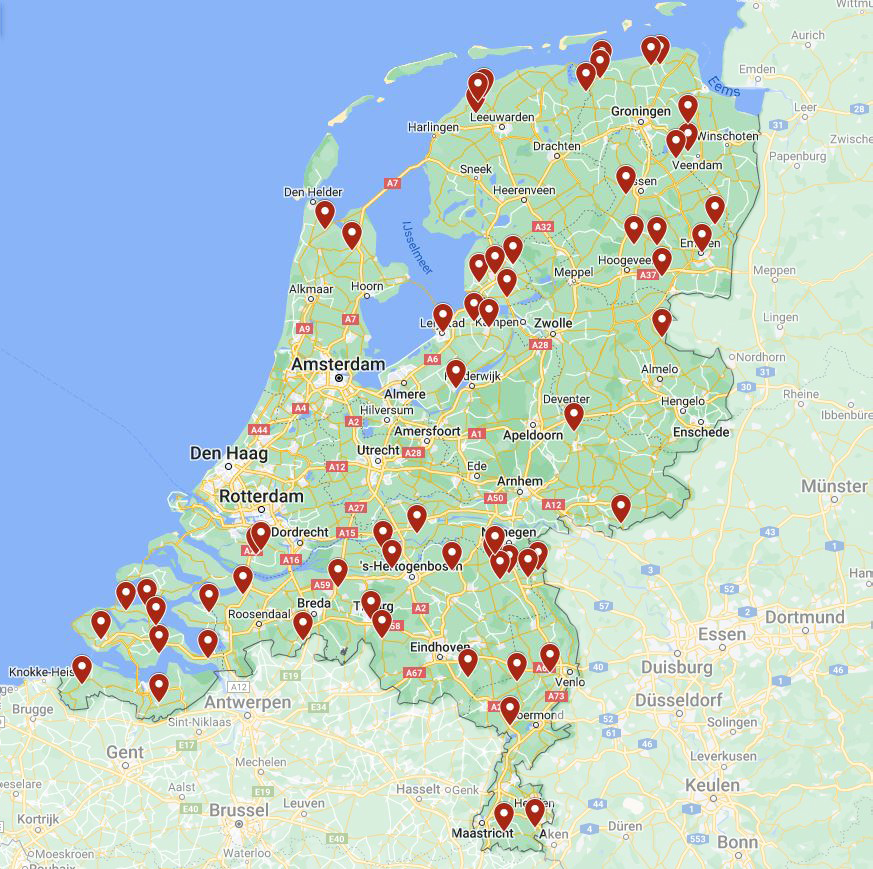
Figuur 10.7.14 Percelen besmet met BMYV (rood) op basis van de ingezonden diagnostiekmonsters in 2020 tot en met 2022.
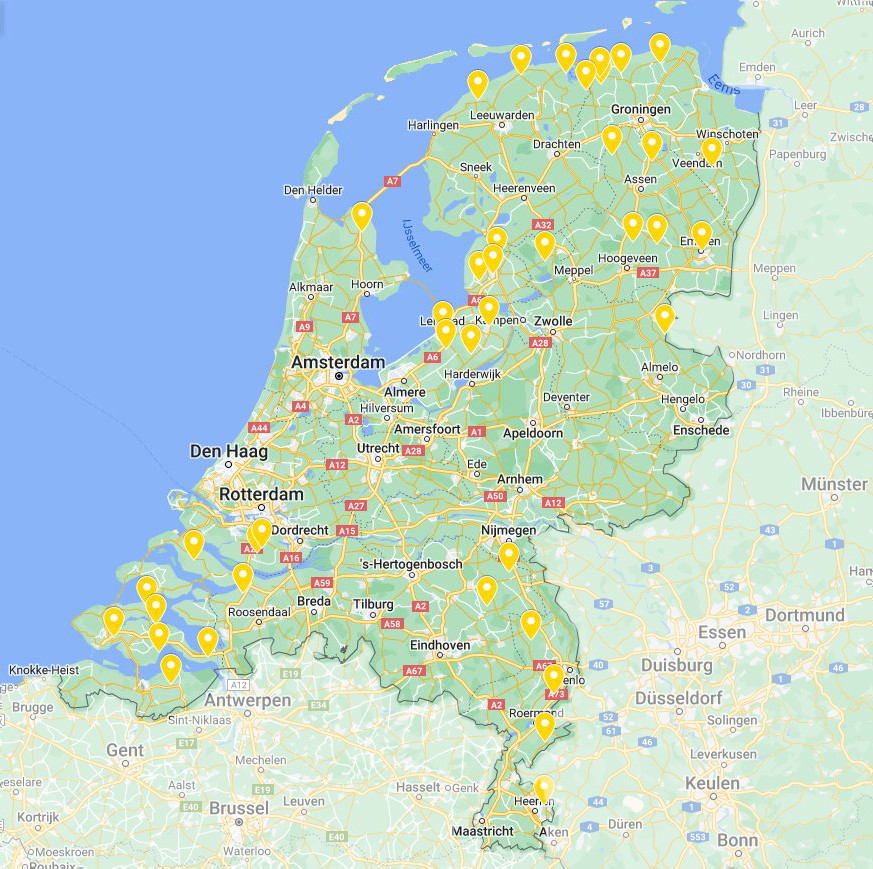
Figuur 10.7.15 Percelen besmet met BChV (geel) op basis van de ingezonden diagnostiekmonsters in 2020 tot en met 2022.
10.7.2.1 Schade
Vanaf het moment van infectie duurt het ongeveer vier tot negen weken voordat de symptomen verschijnen. De symptomen van vergelingsziekte verschijnen als eerste op de geïnfecteerde bladeren. Van daaruit wordt het virus naar het hart van de plant getransporteerd, waardoor ook nieuw gevormde bladeren geel verkleuren. Bladeren die ouder zijn dan het geïnfecteerde blad, blijven groen en op die manier is terug te rekenen wanneer de infectie heeft plaatsgevonden. De schade veroorzaakt door BYV, BMYV en BChV kan oplopen tot respectievelijk 50, 35 en 30%. De uiteindelijke opbrengstderving is afhankelijk van het tijdstip van eerste infectie. Uit proeven is gebleken dat vroege infecties tot meer schade leiden dan late infecties (figuur 10.7.16). Dit komt vooral omdat bij vroege infectie de biet al snel gele bladeren krijgt, waardoor de fotosynthesecapaciteit al eerder laag is en de wortelgroei en de opbouw van het suikergehalte stagneert. De aantasting veroorzaakt door vergelingsvirussen verschilt van jaar tot jaar (figuur 10.7.17). De temperatuur in de winter speelt in de mate van aantasting vooral een grote rol, omdat veel groene perzikluizen dood gaan als de temperatuur in de winter meerdere dagen onder de -7°C is. Bovendien bevriezen dan ook bietenkoppen en onkruiden, die ook een bron van virus kunnen zijn. Lage temperaturen in de winter zorgen voor een lagere druk van bladluizen en virus in het voorjaar. De snelheid waarmee de bladluispopulaties zich opbouwen is in het voorjaar afhankelijk van de temperatuur. Hogere temperaturen leiden tot een snellere vermeerdering en dus ook hogere virusdruk. Ingrijpen zodra de schadedrempel van de groene bladluizen wordt overschreden, beperkt de mate van aantasting op een perceel. Zie voor meer informatie over de schadedrempels paragraaf ˈBladluizenˈ (10.3.3.4).
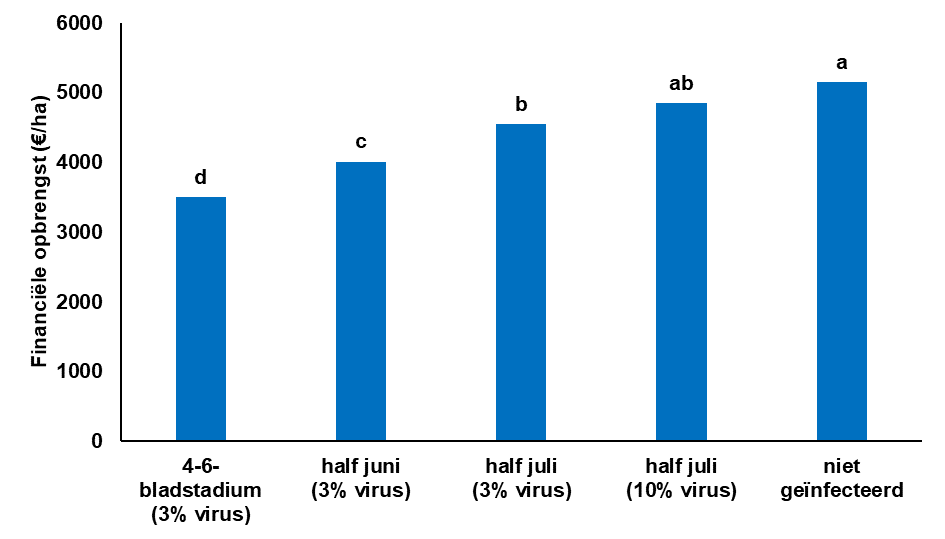
Figuur 10.7.16 De invloed van verschillende infectietijdstippen met BMYV op de financiële opbrengst (2022). Deze figuur laat zien dat infecties vroeg in het seizoen veel schade kunnen veroorzaken, maar dat infecties laat in het seizoen niet meer leiden tot schade.
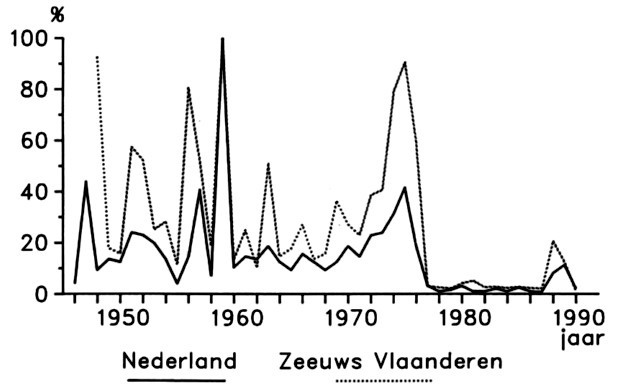
Figuur 10.7.17 De mate van vergelingsziekte in Nederland en Zeeuws-Vlaanderen van 1948 t/m 1990.
10.7.2.2 Virusoverdracht
In tabel 10.7.1 is informatie te vinden over de overdrachtsefficiëntie van virussen door de groene perzikluis en de zwarte bonenluis. De groene perzikluis is de belangrijkste overbrenger van deze virussen. Daarnaast spelen de sjalottenluis, de aardappeltopluis en de kuilluis nog een kleine rol. De zwarte bonenluis kan alleen BYV overbrengen, maar doordat deze bladluis zich vestigt op één bietenplant en vaak niet verplaatst van biet naar biet (en de overdrachtsefficiëntie door deze bladluis bovendien lager is dan van de groene perzikluis) zorgt deze luizensoort voor maar weinig verspreiding van dit virus. BYV wordt semi-persistent overgedragen door bladluizen, terwijl BMYV en BChV persistent worden overgedragen. Persistent betekent dat het virus het hele leven lang in de bladluis aanwezig is en de bladluis zijn hele leven voor infecties kan zorgen. Semi-persistent betekent dat de bladluis het virus verliest zodra zij vervelt en dus het virus maar een gedeelte van zijn leven kan overbrengen. Een nakomeling van een virus besmette bladluis draagt het virus niet bij zich, maar kan dit wel opnemen van een zieke plant. Dit geldt voor BYV, BMYV en BChV.
Tabel 10.7.1 Overdrachtsefficiëntie van de drie vergelingsvirussen (BYV, BMYV en BChV) door de groene perzikluis en de zwarte bonenluis.
| virus | overdrachtsefficientie (%) | |
| groene perzikluis | zwarte bonenluis | |
| BMYV & BChV | 28-100 | 0-1 |
| BYV | 51-73 | 28-40 |
Bron: Limburg et al. (1997); Schliephake et al. (2000); Kozlowska-Makulska et al. (2009).
Vermijd virusbronnen
Virusbronnen zijn onder andere spinazie, ganzenvoetachtigen, vogelmuur, kruiskruid, kuilen met voederbieten en ook bietenopslag. Zie tabel 10.7.2 voor een volledig overzicht. Om bladluizen in het volgend voorjaar zo min mogelijk kans te geven virus te verspreiden, is het belangrijk onkruiden zowel tijdens als na teelten goed te beheersen, oogstverliezen te beperken en niet-geleverde bieten op tijd op te ruimen (zie paragraaf 5.2.1). Om verspreiding van vergelingsziekte tegen te gaan, heeft de NVWA een teeltvoorschrift op haar website staan, waarin staat dat suikerbieten, voederbieten en rode bieten met bladvorming niet voorhanden of in voorraad mogen zijn en dus opgeruimd moeten worden voor 15 maart. Ook dienen telers opslag van suikerbieten, voederbieten en rode bieten in percelen te bestrijden om overdracht van virussen naar nieuw ingezaaide bietenpercelen te voorkomen. Dit dient te gebeuren voor 15 april. Het is namelijk bekend dat bladluizen zich in het voorjaar vanuit de geïnfecteerde bietenhopen en bietenplanten tot zeker 500 meter verplaatsen en virussen kunnen verspreiden. Meer informatie hierover is te vinden op de website van de NVWA.
Meer informatie
Meer informatie over vergelingsziekte is te vinden in:
- vraagbaak op www.irs.nl/alle/vraagbaak/vragen-over-vergelingsziekte;
- het artikel ˈVoorkom overleving van vergelingsvirussen in de winterˈ;
- het artikel ˈEffect van klimaatverandering op vergelingsziekteˈ;
- het artikel ˈVerspreiding van vergelingsziekteˈ;
- publicatie ˈBladluiswaarschuwingsdienst 2020ˈ;
- publicatie ˈBladluiswaarschuwingsdienst beperkt schade door vergelingˈ
- publicatie ‘Vergelingsziekte in 2024 mogelijk vroeger’
- publicatie ‘Vergelingsziekte: beheersing in de winter’
- publicatie ‘Vergelingsziekte: beheersing in de zomer’.
Tabel 10.7.2 Waardplantstatussen van diverse plantensoorten voor de drie vergelingsvirussen (BYV, BMYV en BChV) en de belangrijkste overdrager van deze virussen, de groene perzikluis (Myzus persicae).
| vergelingsvirus | groene perzikluis | ||||
| Latijnse naam | Nederlandse naam | BYV | BMYV | BChV | |
| Crambe abyssinica | Afrikaanse bolletjeskool | ? | ja | nee | ? |
| Misopates orontium | akkerleeuwenbek | ? | ? | nee | ? |
| Myosotis arvensis | akkervergeet-mij-nietje | nee | nee | ? | ? |
| Viola arvensis | akkerviooltje | nee | ja | ? | ? |
| Convolvulus arvensis | akkerwinde | ? | ? | ? | ja |
| Artemisia vulgaris | bijvoet | nee | nee | nee | nee |
| Raphanus sativus subsp. Oleiferus | bladrammenas | nee | nee | ja (?) | ja |
| Lupinus angustifolius | blauwe lupine | ? | ? | nee | nee |
| Fagopyrum esculentum | boekweit | ? | ? | nee | ja |
| Agrostemma githago | bolderik | ? | ? | nee | nee |
| Montia perfoliata | bronkruid soort | ja | ja | nee | ? |
| Anethum graveolens | dille | nee | ja | ||
| Matricaria chamomilla | echte kamille | nee | ja | nee | ja |
| Chrysanthemum segetum | gele ganzenbloem | nee | ja | ? | ? |
| Sinapis alba | gele mosterd | nee | ja | nee | ? |
| Fumaria officinalis | gewone duivenkervel | ? | ja | ? | ? |
| Sonchus oleraceus | gewone melkdistel | nee | ja | ? | ja |
| Spergula arvensis | gewone spurrie | ja | ja | ja | ? |
| Gypsophila muralis | gipskruid | ? | ? | nee | nee |
| Veronica persica | grote ereprijs | nee | ? | ? | ? |
| Papaver rhoeas | grote klaproos | nee | ja | nee | ja |
| Plantago major | grote weegbree | ja | ja | ? | ? |
| Anagallis arvensis | guichelheil | nee | ja | ? | ? |
| Capsella bursa-pastoris | herderstasje | nee | ja | nee | ja |
| Sinapis arvensis | herik | ja | ja | ? | ? |
| Lamium amplexicaule | hoenderbeet | ? | ja | ? | ? |
| Aethusa cynapium | hondspeterselie | ? | ? | ? | ? |
| Matricaria perforata | reukloze kamille | nee | nee | ? | ? |
| Senecio vulgaris | klein kruiskruid | nee | ja | nee | ? |
| Crepis capillaris | klein streepzaad | nee | ja | ? | ? |
| Malva parviflora | kleinbloemig kaasjeskruid | nee | ? | ? | ja |
| Urtica urens | kleine brandnetel | nee | nee | ? | ? |
| Veronica hederifolia | klimopereprijs | nee | ja | ? | ja |
| Raphanus raphanistrum | knopherik | nee | nee | ? | ? |
| Brassica napus | koolzaad | ? | nee | nee | ja |
| Centaurea cyanus | korenbloem | ? | nee | ? | ja |
| Physalis wrightii | lampionplant | ? | ? | nee | ja |
| Leucanthemum vulgare | margriet | ? | ? | nee | ja |
| Chenopodium album | melganzenvoet | ja | nee | ? | ? |
| Silene alba | avondskoekoeksbloem | nee | nee | ? | ? |
| Tetragonia expansa | Nieuw-Zeelandse spinazie | ja | ja | ja | ? |
| Taraxacum spp | paardenbloem | nee | ? | ? | ? |
| Lamium purpureum | paarse dovenetel | ja | ja | ? | ? |
| Amaranthus retroflexus | papegaaienkruid | ? | ja | ? | ja |
| Capsicum annuum | rode peper/Spaanse paprika | ? | nee | nee | ? |
| Zinnia peruviana | Peruaanse zinnia | ? | ja | ? | ? |
| Persicaria maculosa | perzikkruid | ? | ? | ? | ? |
| Trifolium resupinatum | Perzische klaver | ? | ? | nee | ja |
| Phacelia tanacetifolia | facelia | ? | ja | ? | ja |
| Portulaca oleracea | postelein | ja | nee | nee | ? |
| Rumex obtusifolius | ridderzuring | ? | ? | ? | ? |
| Rumex acetosella | schapenzuring | nee | nee | ? | ? |
| Lactuca sativa | sla | nee | nee | nee | ja |
| Plantago lanceolata | smalle weegbree | nee | ja | ? | ? |
| Spinacia oleracea | spinazie | ja | ja | ja | ja |
| Chenopodium vulvaria | stinkende ganzevoet | nee | ja | ? | ? |
| Poa annua | straatgras | nee | nee | ? | ? |
| Beta vulgaris | suikerbiet | ja | ja | ja | ja |
| Mercurialis annua | tuinbingelkruid | nee | ja | ? | ? |
| Atriplex patula | uitstaande melde | ja | nee | ? | ? |
| Rumex acetosa | veldzuring | nee | nee | ? | ? |
| Linum | vlas | ? | ja | ? | ? |
| Vicia sativa | voederwikke | ? | ? | nee | nee |
| Stellaria media | vogelmuur | ja | ja | nee | ja |
| Consolida regalis | wilde ridderspoor | nee | nee | ||
| Claytonia perfoliata (syn. Montia perfoliata) | winterpostelein | ja | ja | nee | ? |
| Melilotus albus | witte honingklaver | ? | ? | nee | nee |
| Thlaspi arvense | witte krodde | nee | ? | nee | ? |
| Potentilla anserina | zilverschoon | nee | ja | ? | ? |
| Fallopia convolvulus | zwaluwtong | ? | ja | ? | ? |
| Solanum nigrum | zwarte nachtschade | nee | nee | ? | ja |
Bronnen: IRS onderzoek, Stevens (1994), Harveson (2009), Fernandez-Quitanilla (2001), Hauser (2001), Graichen Rabenstein (1996), Jadot (1974), Winner (1988), Stevens (2003), Wallis (1967), Moreno et al (2004), Stephan en Maiss (2005), Beuve et al. (2008), Yoshida en Tamada (2019) en Brunt et al. (1996).